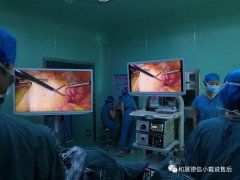
输尿管肾镜
支气管纤维镜
腹腔镜
可偏转电子内窥镜
腹腔镜
鼻咽喉纤维镜
气管插管纤维镜
自动内窥镜再处理器等(详细查看下图)
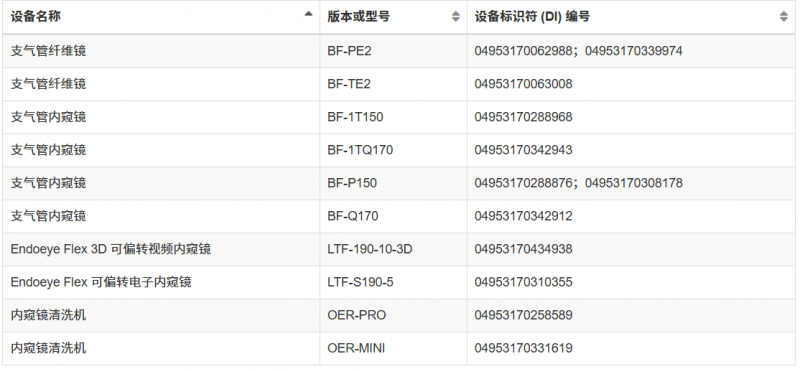
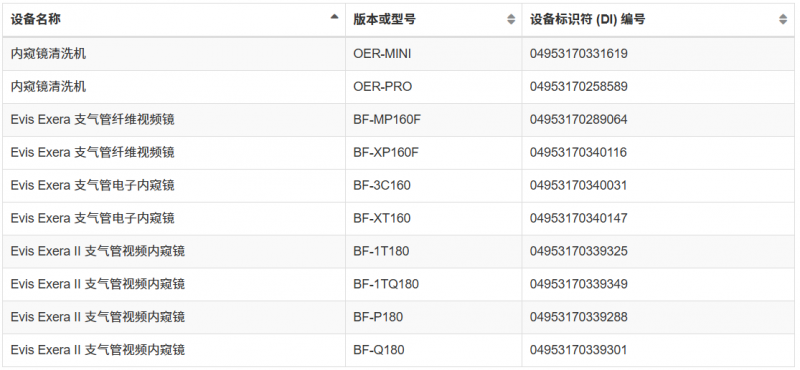
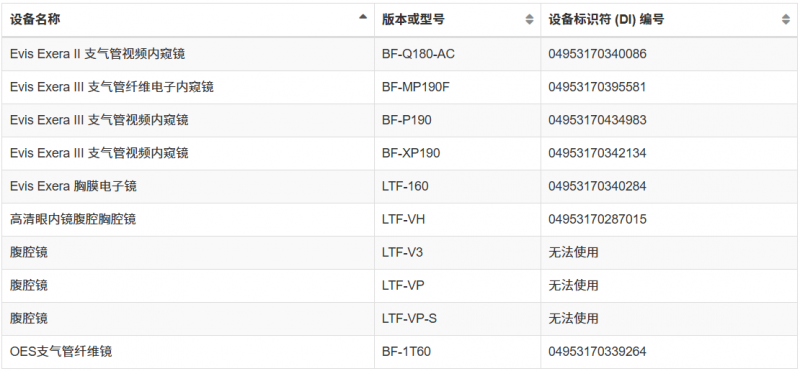
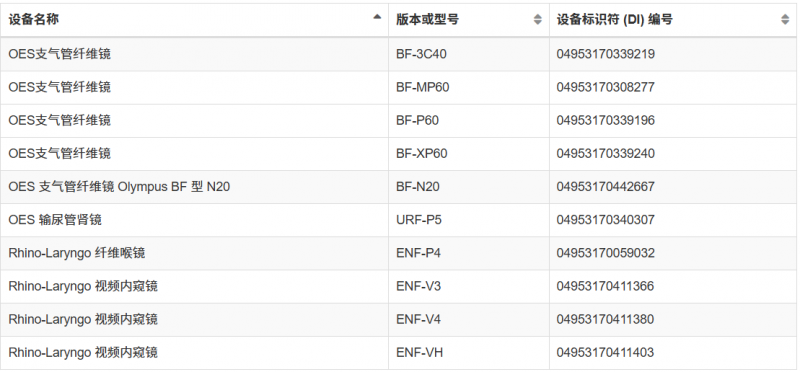
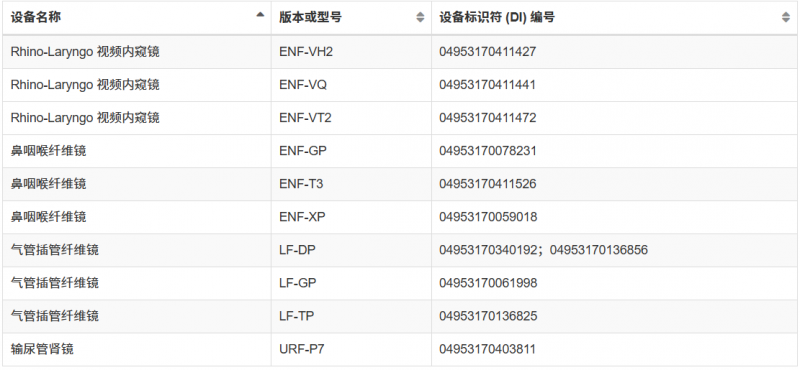
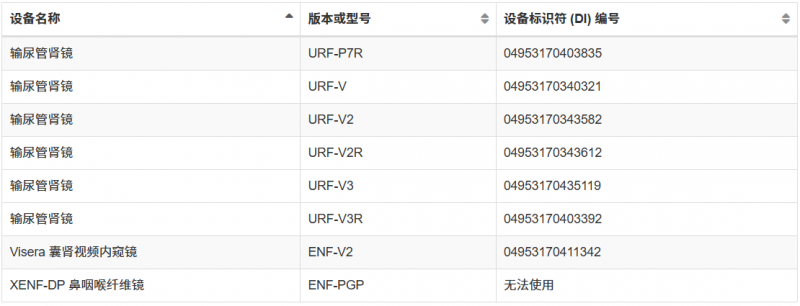
这并非FDA首次对奥林巴斯内窥镜发出警告信。从2022年11月至2025年5月期间,FDA几度向奥林巴斯发出警告信,旨在降低再处理内窥镜引发的感染风险。但随后检查依旧发现奥林巴斯严重违反现行生产管理规范,且至今未完成整改。
2022年11月:FDA向奥林巴斯位于福岛县Aizu的生产基地发出警告信,剑指其缺乏关键的组装和清洁过程的书面程序和文件——这是质量管理体系(QMS)的基石。
2023年1月:媒体曝光奥林巴斯在短短5个月内收到了FDA的第三封警告信。这一次,问题直指其迟报、瞒报设备故障的严重失职行为。
2023年3月:仅仅几个月后,FDA发出第四封警告信,原因是东京工厂生产的十二指肠镜和支气管镜配件存在致命缺陷:远端端帽破裂,甚至在手术过程中在患者体内松动!FDA的调查源于令人不寒而栗的客户投诉。
2023年12月:FDA对奥林巴斯超过17600个纤维支气管镜和视频支气管镜(涉及2001年以来在美国销售的产品)发出了最严重的一级召回令。召回原因触目惊心:当这些设备与高频烧灼设备在高氧环境下同时使用时,已导致患者肺部灼伤!
2025年2月:奥林巴斯对其内窥镜部件再次展开召回行动,召回级别为最严重的一级,有报道称相关产品已造成120人受伤和1人死亡。FDA表示,如果系列产品未按照指示执行彻底清洗和拆卸,则可能会无意中保留生物材料。患者接触受污染的设备可能会导致感染、败血症或死亡等伤害。
FDA建议措施
本次进口警示不适用于配套产品(如替换零件、连接器或一次性耗材)
若正在使用被警示设备且未出现故障,可继续使用
严格遵循标签说明及再处理规程对设备(含配件)进行清洁消毒
禁止使用已损坏或未通过泄漏测试的设备(可能存在污染风险)
依据制造商指引制定定期检查与维护计划
与患者充分沟通相关诊疗操作的获益与风险:未经医患风险获益评估,FDA不建议取消或推迟手术
及时上报不良事件(助力FDA识别和评估设备风险)
FDA后续监管
FDA已针对奥林巴斯的质量体系问题采取多项措施,并将持续敦促其加速整改现有违规行为以降低患者风险,必要时采取进一步行动。FDA始终恪守保障医疗器械安全有效的职责。若获得新增信息,将及时向医疗服务机构及公众通报。
奥林巴斯整改
在5月财报会议中奥林巴斯表示:公司计划在2026财年末(即2027年3月前)完成FDA要求的整改。据披露,奥林巴斯2025财年已投入110亿日元(约合5亿人民币)推进合规改造项目。
奥林巴斯在内窥镜市场举足轻重——全球软镜市场占有率高达65%,中国市场更达70.8%;除软镜以外,其硬镜领域其也位居第一梯队。
主力产品线突遭进口限制,无疑为竞争对手(如卡尔史托斯、富士、迈瑞等)提供了抢占市场份额的绝佳窗口。更重要的是,FDA此次不惜动用进口禁令这一“核选项”,向整个医疗设备行业传递了极其明确的信号:任何对质量体系要求的系统性、持续性漠视,都将面临最严厉的监管制裁,毫无侥幸可言。

 安科高技术
安科高技术 医准智能
医准智能 明峰医疗
明峰医疗 迈瑞医疗
迈瑞医疗 之江生物
之江生物 雷杜生命
雷杜生命 迪瑞医疗
迪瑞医疗 万泰生物
万泰生物 迈克生物
迈克生物 爱威科技
爱威科技 基蛋生物
基蛋生物 万孚生物
万孚生物 睿心医疗
睿心医疗 润迈德医疗
润迈德医疗 爱博医疗
爱博医疗 佗道医疗
佗道医疗 瑞龙诺赋
瑞龙诺赋 微光医疗
微光医疗 联影医疗
联影医疗 内镜精灵
内镜精灵 精微视达
精微视达 迈瑞医疗
迈瑞医疗 迪安诊断
迪安诊断 华科精准
华科精准 威高机器人
威高机器人 精锋医疗
精锋医疗 微创机器人
微创机器人 术锐技术
术锐技术 业聚医疗
业聚医疗 佰仁医疗
佰仁医疗 博迈医疗
博迈医疗 健世科技
健世科技 启明医疗
启明医疗 赛诺医疗
赛诺医疗 沛嘉医疗
沛嘉医疗 先健科技
先健科技 HH-3658Ⅲ电脑快速冷冻、石蜡两用切片机
HH-3658Ⅲ电脑快速冷冻、石蜡两用切片机 EB-500电子支气管内窥镜
EB-500电子支气管内窥镜 麦迪特便携式三道心电图机EKG101T
麦迪特便携式三道心电图机EKG101T 德国M-15氧气传感器
德国M-15氧气传感器 上正华瑞智慧公卫体检系统/慢病随访签约系统-国家高新技术企业
上正华瑞智慧公卫体检系统/慢病随访签约系统-国家高新技术企业 麦亲贝 经皮黄疸测试仪 ME100
麦亲贝 经皮黄疸测试仪 ME100 麦迪特可移动医疗推车 急救推车支持定制
麦迪特可移动医疗推车 急救推车支持定制 OOM202氧气传感器(O2传感器,氧电池,氧探头,氧电极)
OOM202氧气传感器(O2传感器,氧电池,氧探头,氧电极)