近年来,新光维医疗在内窥镜赛道持续发力。据不完全统计,从2020年到目前截稿为止,新光维医疗的内镜产品因经过NMPA检验或者批准上市而出现在国家药监局官网的次数累计约有15次。

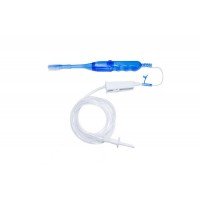
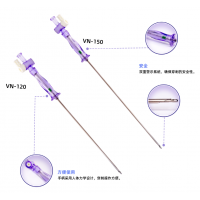
在今年6月5日,新光维医疗再现身影,其胸腹腔内窥镜再此获得国家级医疗器械注册证。该产品具有以下四大特点:
1.高清晰度图像:该内窥镜配备了高清晰度摄像头,能够提供清晰、高保真的图像,帮助医生进行手术操作。
2.多功能性:该内窥镜可以用于许多不同类型的手术,包括胸腔手术、腹腔手术、以及心脏手术等。
3.微侵入性:与传统手术方式相比,内窥镜手术针对患者肌肉、软组织以及骨骼等部位的侵袭性更小,患者术后恢复时间更快。
4.精确性:内窥镜操作相对传统手术更为精细,因此患者在手术中的创伤程度更小,并且手术过程更安全、更可控。
值得注意的是,胸腹腔内窥镜连续三年获得NMPA注册认证,分别在2021年5月27日、2022年12月22日和2023年6月2日受到NMPA批准上市。此外,新光维医疗的关节镜等产品也受到NMPA认可。
作为一家专注研发与销售医用内窥镜的领先企业之一,新光维医疗不仅在争取获得NMPA注册证的路上持续发力,而且朝着国产内窥镜全球化方向,踏出重要的一步又一步,正在砥砺践行“全球梦”。
就在6月2日同一天,正式启用定位于苏州园区的全球总部及研发生产基地,集总部管理、研发、生产、销售、培训、产品展示与体验等功能于一体,从而为提升全球研发创新能力而优化全球市场布局。
目前来看,为描绘医用内窥镜的全球发展版图,新光维早在内窥镜技术、产品矩阵、资金储备以及合作关系等方面循序渐进地布局,并且朝着全球化方向往前走。
从技术层面来看,新光维在中国苏州和日本东京均设有研发中心,聚焦于图像处理的研究开发和内窥镜技术创新,目前已掌握超高清成像技术(如4K成像)、3D成像技术、特殊光成像技术(如荧光成像)、超细内镜成像技术、内镜耗材化技术(一次性使用技术)。
据弗若斯特沙利文统计,新光维医疗是全球唯一一家成功开发具有2D转3D功能的内窥镜系统的公司,也是中国唯一一家4K内窥镜成像系统和4K内窥镜镜体均获FDA批准商业化的公司,并且还是中国唯一一家成功将自主研发的3D内窥镜系统销往海外市场及中国三甲医院的公司。

从产品矩阵来看,新光维医疗依托其强大的自主研发能力,围绕不同科室打造“重复使用内窥镜+一次性使用内窥镜+配套内窥镜设备”的产品矩阵。目前一次性使用电子输尿管肾孟内窥镜、一次性使用电子胆道内窥镜以及一次性使用电子支气管内窥镜等多款产品在中国、美国、欧盟、日本等国家及地区获批认证,并覆盖妇科、呼吸科、泌尿外科、肝胆外科等多个科室。
从资金储备来看,新光维医疗在2018年12月获得利来亚洲基金天使轮投资;2021年4月完成4亿元的A轮融资,本轮融资由高瓴创投、礼来亚洲基金联合领投、经纬中国、美敦力等参投;2021年8月,B轮融资募集资金达到4亿元,投资者包括Hudson Bay Capital Management、涌金资本等新增投资机构,老股东高瓴创投、礼来亚洲基金、经纬中国继续加码。
从合作关系来看,在2022年11月,新光维医疗与富士胶片欧洲私营有限公司达成战略合作,富士胶片作为独家分销商,负责新光维医疗一次性使用电子支气管内窥镜在欧洲一些主要国家的销售和业务拓展。在2023年3月,与波士顿科学正式达成商业合作,双方计划就一次性使用电子胆道内窥镜(经皮)在中国大陆地区的 商业化推广及市场销售上建立长期合作。
对于国产内窥镜全球发展,苏州工业园区党工委委员、管委会副主任刘华表示:“新光维医疗是园区本土医疗器械企业通过自主研发走向国际市场的代表,期待公司持续加强本土创新和人才培养,引领本土高端医疗器械企业的创新发展。园区将对标一流,充分发挥中新合作、自贸片区等平台优势,持续推进政策和制度创新突破,构建更加完善、更具竞争力的开放创新生态,加快打造具有国际影响力的高端医疗器械产业集聚区和创新策源地。

 安科高技术
安科高技术 医准智能
医准智能 明峰医疗
明峰医疗 迈瑞医疗
迈瑞医疗 之江生物
之江生物 雷杜生命
雷杜生命 迪瑞医疗
迪瑞医疗 万泰生物
万泰生物 迈克生物
迈克生物 爱威科技
爱威科技 基蛋生物
基蛋生物 万孚生物
万孚生物 睿心医疗
睿心医疗 润迈德医疗
润迈德医疗 爱博医疗
爱博医疗 佗道医疗
佗道医疗 瑞龙诺赋
瑞龙诺赋 微光医疗
微光医疗 联影医疗
联影医疗 内镜精灵
内镜精灵 精微视达
精微视达 迈瑞医疗
迈瑞医疗 迪安诊断
迪安诊断 华科精准
华科精准 威高机器人
威高机器人 精锋医疗
精锋医疗 微创机器人
微创机器人 术锐技术
术锐技术 业聚医疗
业聚医疗 佰仁医疗
佰仁医疗 博迈医疗
博迈医疗 健世科技
健世科技 启明医疗
启明医疗 赛诺医疗
赛诺医疗 沛嘉医疗
沛嘉医疗 先健科技
先健科技 经皮穴位刺激仪、低频治疗仪、电子脉冲仪、镇痛仪
经皮穴位刺激仪、低频治疗仪、电子脉冲仪、镇痛仪 上正华瑞大型立式健康管理一体机
上正华瑞大型立式健康管理一体机 负压罐
负压罐 数字病理、病理切片扫描仪
数字病理、病理切片扫描仪 Drager原装负压泵过滤器(麻醉机过滤器)8402868
Drager原装负压泵过滤器(麻醉机过滤器)8402868 柯尔单水平呼吸机Q20AW
柯尔单水平呼吸机Q20AW 急救气控呼吸机系列QS-100A急救呼吸机
急救气控呼吸机系列QS-100A急救呼吸机 OOM102氧电池,适用于Elisa呼吸机
OOM102氧电池,适用于Elisa呼吸机