文章来源:医疗器械创新网
又一家采用科创板第五套上市标准的IPO项目宣布终止。12月25日,上交所发布公告表示,因北京华脉泰科医疗器械股份有限公司(简称“华脉泰科”)及其保荐人撤回发行上市申请,终止其发行上市审核。华脉泰科于2022年底上市申请获受理,3月底回复首轮问询,此后审核就处于停滞状态,直到如今撤回。
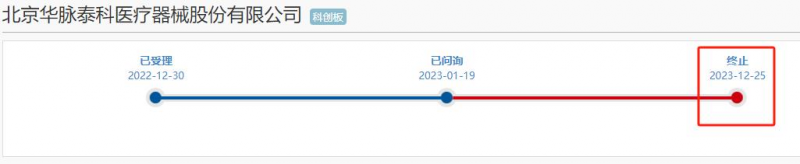
招股书显示,华脉泰科是一家专注于主动脉、外周及冠脉、神经介入及通路领域产品及疗法的医疗器械公司,报告期内公司持续亏损三年半,净利润合计亏损超3亿元。为此,公司采用了科创板第五套标准申报,该标准未对净利润甚至营业收入作要求。
自2023年6月智翔金泰成功上市以来,半年时间尚无任何一家采取第五套标准的公司顺利登陆科创板。东财choice数据显示,截至2023年12月25日,采用第五套标准的科创板在会项目共有16家,均为医药制造或医疗器械企业,大部分处于“中止”或“暂缓审议”状态,已过会的思睿哲、比贝特提交注册暂无结果,而已注册生效的新通药物暂未发行。
拟募资12.39亿元
国产介入龙头采用“标准五”上市
根据招股书,成立于2011年的华脉泰科是一家专注于血管疾病治疗领域创新产品及疗法研发与应用的医疗器械公司。在主动脉、外周及冠脉、神经介入及通路领域,华脉泰科已有 8 款产品取得了NMPA医疗器械产品注册证,2 款产品取得了欧盟CE认证。此外,公司还有20余款在研产品处于临床试验及临床前研究阶段。
公司产品已覆盖全国31个省、自治区和直辖市的400余家医院,包括首都医科大学附属北京安贞医院、复旦大学附属中山医院、中山大学附属第一医院、海军军医大学第二附属医院(上海长征医院)等国内知名三甲医院。
公司的腹主动脉覆膜支架系统于2015年进入创新医疗器械特别审批程序并于2017年获批上市;胸主动脉覆膜支架系统于2017年进入医疗器械优先审批程序并于2019年获批上市;多分支人工血管覆膜支架系统于2020年4月进入创新医疗器械特别审批程序,公司自主研发的技术成果已逐渐转化成为覆盖全血管疾病治疗领域较为齐全的产品线。
财务方面,公司报告期内(2019年到2021年,及2022年上半年)营业收入分别为4894万元、5000万元、8882万元和6083万元。公司净利润则处于持续亏损状态,分别录得-3281.25万元、-1.26亿元、-1.2亿元及-2754.18万元,累计亏损超3亿元。
因主业贡献现金流不佳,华脉泰科报告期内靠持续融资维持运转。自2014年以来,公司历史上共发生8轮融资,其中在报告期内发生三轮,2019年至2021年每年各融资一次。 投资者包括礼来亚洲基金、元生创投、龙磐投资、高瓴创投、通用创投、建银国际等20余家机构,按照最后一轮融资计算,公司上市前估值达37.12亿元。
根据《上海证券交易所科创板股票发行上市审核规则》第二十二条第二款第(五)项规定的上市标准:预计市值不低于人民币40亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展二期临床试验。此背景下,华脉泰科目前已取得阶段性成果,符合其他科创板定位需具备明显的技术优势等相应条件。
公司IPO申请于2022年12月30日获科创板受理,保荐人为中信证券。公司本次公开发行股票的数量为2400万股,占发行后股本比例不低于25%,拟融资12.93亿元,募集资金(扣除发行费用后)将用于公司主营业务相关项目。
主动脉国内细分第三
与美敦力、心脉等仍有较大差距
根据中国心血管病中心发布的《中国心血管健康与疾病报告2021》,中国心血管病现患人数为3.3亿;在外周血管介入领域,预计到2023年,中国外周动脉疾病患者人数将增长至5596万人。同时,随着中国新冠疫情得到有效控制,血管介入器械市场规模将恢复高速增长,预计2022年中国市场规模将增长至659.4亿元,行业发展前景较好。
值得一提的是,血管介入属于技术密集型领域,创新技术门槛高,产品标准化程度低,目前国外品牌仍然占据绝对优势。从行业发展来说,近年来国内外血管介入领域因为技术壁垒高、价值属性高等特性一直都是医疗器械领域的大热点。
据披露,我国主动脉疾病治疗市场仍由跨国企业主导,主要外资厂商为美敦力、戈尔、库克等,2021 年在胸/腹主动脉医疗器械市场外资品牌占有率合计均超过 50%以上。其中美敦力长期处于行业龙头地位,2021 年其在胸/腹主动脉腔内介入医疗器械市场份额分别在 30%和 45%以上。
经过十余年的发展,中国企业取得了不错的进展,以心脉医疗为例,公司于2002年推出首款产品,2021年在胸主动脉介入器械和腹主动脉介入器械市场份额分别为28.2%和15.26%。
即使在国内厂商中,华脉泰科的市场份额也只能排到第三,前面两位是心脉医疗和先健医疗,与前两名存在较大差距。针对此情况,公司强调了自己产品在技术上的领先,认为“相比于既有竞争者,全国市场销售渠道的培育与开拓是公司当下业务推广阶段的首要任务。”
在IPO审核的问询中,监管部门明确指出:公司胸主动脉覆膜支架于2019 年获批上市,可以适用于B型夹层腔内修复术10mm的锚定区长度,优于同类竞品大多适用于15-20mm的锚定范围,但在国内市场的手术量及销售额占比也不高;
公司腹主动脉覆膜支架于2017年获批上市,可以治疗瘤颈长度大于 10mm、肾下角在0-75度范围的短瘤颈动脉瘤,优于同类竞品普遍大于15mm瘤颈长度、肾下角0-60度的适用症范围,但在国内市场的手术量及销售额占比均不高。
对此,监管部门在问询中,明确要求华脉泰科:说明较主要竞品新增覆盖的患者人数、手术量及占比,是否满足了显著的临床需求;除锚定区长度外,发行人与竞品相比在其他性能方面的优劣势,是否存在可替代的术式或产品组合;结合前述因素,谨慎分析发行人胸主支架的临床价值和市场空间。简而言之就是既然相对于竞品有这样或者那样优势,但是为什么市场份额上不去?
科创板“标准五”从严,
械企上市更难了?
2022年6月,上海证券交易所制定了《上海证券交易所科创板发行上市审核规则适用指引第7号——医疗器械企业适用第五套上市标准》,为尚未盈利的医疗器械企业申报科创板提供了指引性文件,具体要求包括:符合国家医疗器械科技创新战略;拥有关键核心技术;核心技术产品研发应当取得阶段性成果;满足主要业务或产品市场空间大的标准;不存在核心技术产品研发失败的情况;不存在主要业务或产品商业化销售预期明显不足的情况。
医疗器械企业具有研发周期较长、投入较高、风险较大等特点,容易长期处于未盈利状态。受制于盈利条件限制,尚处于未盈利状态的研发型企业在A股上市融资受限。
相比于其他上市标准,第五套标准不对营业收入、净利润、现金流等财务指标作要求,而是对市值、主要业务或产品的研发进展、市场空间等进行规定,尤其是对于医药行业企业,进一步要求“需至少有一项核心产品获准开展二期临床试验”。因此,受到了医疗领域硬科技企业的欢迎。
值得一提的是,虽然上市规则没有对企业的财务数据做出要求,但从实际审核情况来看,“0”收入企业闯关成功率并不高。截至2023年4月30日,共有42家企业采用第五套标准申请科创板上市,其中已发行上市19家,注册生效2家,7家已主动撤回、终止审核,14家处于审核问询阶段。在42家采用第五套标准申请上市的企业中,除已上市的19家企业,共有23家在审核或终止上市的企业。
不久前,已有多家媒体报道提及,科创板第五套上市标准或将趋于收紧,监管将对采用第五套上市标准递交材料申报的企业,进行更加严格的审核。
对此,据行业人士分析,对于采用第五套标准上市的企业,主要是考虑到其主要产品尚处于研发阶段,为给生物医药企业研发创新留足空间和过渡期。而最早从 2024 年开始,以第五套标准上市的企业将逐渐迎来“审判”,如果彼时这些企业还未能满足相关的财务要求,仍将面临退市。同时,对于未盈利企业,其实际控制人以及核心人员的减持受到更为严格的监管。

 安科高技术
安科高技术 医准智能
医准智能 明峰医疗
明峰医疗 迈瑞医疗
迈瑞医疗 之江生物
之江生物 雷杜生命
雷杜生命 迪瑞医疗
迪瑞医疗 万泰生物
万泰生物 迈克生物
迈克生物 爱威科技
爱威科技 基蛋生物
基蛋生物 万孚生物
万孚生物 睿心医疗
睿心医疗 润迈德医疗
润迈德医疗 爱博医疗
爱博医疗 佗道医疗
佗道医疗 瑞龙诺赋
瑞龙诺赋 微光医疗
微光医疗 联影医疗
联影医疗 内镜精灵
内镜精灵 精微视达
精微视达 迈瑞医疗
迈瑞医疗 迪安诊断
迪安诊断 华科精准
华科精准 威高机器人
威高机器人 精锋医疗
精锋医疗 微创机器人
微创机器人 术锐技术
术锐技术 业聚医疗
业聚医疗 佰仁医疗
佰仁医疗 博迈医疗
博迈医疗 健世科技
健世科技 启明医疗
启明医疗 赛诺医疗
赛诺医疗 沛嘉医疗
沛嘉医疗 先健科技
先健科技 柯尔医用制氧机CR-P5W
柯尔医用制氧机CR-P5W 麦迪特3.5英寸彩色显示屏除颤仪Defi6
麦迪特3.5英寸彩色显示屏除颤仪Defi6 A6一次性肺功能仪用过滤嘴咬嘴呼吸过滤器过滤嘴
A6一次性肺功能仪用过滤嘴咬嘴呼吸过滤器过滤嘴 柯尔雾化器WHB
柯尔雾化器WHB Drager新生儿Y型流量传感器接头(插座)8410185
Drager新生儿Y型流量传感器接头(插座)8410185 柯尔制氧机3升医用氧浓度超静音制氧机出租
柯尔制氧机3升医用氧浓度超静音制氧机出租 健康一体机HS-V580
健康一体机HS-V580 气压弹道式体外冲击波治疗仪
气压弹道式体外冲击波治疗仪



















