近日,国家药品监督管理局医疗器械技术审评中心(CMDE)发布《创新医疗器械特别审查申请审查结果公示(2025 年第 12 号)》,海迈医疗科技(苏州)有限公司(简称 “海迈医疗”)自主研发的生物型人工血管成功入选,正式进入创新医疗器械特别审查程序,标志着这款国产突破性产品向临床转化迈出关键一步。
我国慢性肾病(CKD)患者已达 1.2 亿,其中超 300 万患者需肾脏替代治疗,2024 年血液透析患者规模突破 102.7 万,且仍以每年 10% 以上速度增长。然而,血液透析患者 5 年生存率仅 33.4%,平均生存时间 4.4 年,远低于欧美发达国家水平,核心痛点之一就是血管通路问题 —— 合适的透析通路是患者的 “生命线”,但传统 ePTFE 人工血管存在通畅率低、易感染、血栓形成等缺陷,难以满足临床需求。
从市场规模来看,全球小口径人工血管市场预计 2025 年突破 50 亿美元,国内市场规模超 50 亿元,且随着透析患者增多持续扩容。目前国内市场几乎被进口 ePTFE 产品垄断,海迈医疗生物型人工血管的出现,不仅将打破进口依赖,更以更优性能填补了国产生物型产品的空白,市场潜力巨大。

关于海迈医疗:再生医学领域的“科创黑马”
成立于 2021 年 9 月的海迈医疗,是一家深耕组织工程与再生医学领域的临床阶段科技企业,总部位于苏州工业园区。作为国内首家、全球第二家具备量产小口径(内径≤6mm)组织工程血管能力的企业。创始人邱雪峰教授深耕血管再生领域多年,先后留学加州大学伯克利分校、洛杉矶分校等顶尖机构,兼具学术深度与产业化经验,带领团队攻克多项技术难关。公司目前已完成 A 轮融资,2024 年 5 月建成 2243 平方米 C+A 级别 GMP 生产车间及质检中心,年产能超 3 万根,为产品规模化落地奠定坚实基础。海迈医疗这款生物型人工血管(商品名:LineMatrix 耐迈通 ®),是专为慢性肾衰患者血液透析通路设计的小口径人工血管,其核心优势直击传统产品痛点:
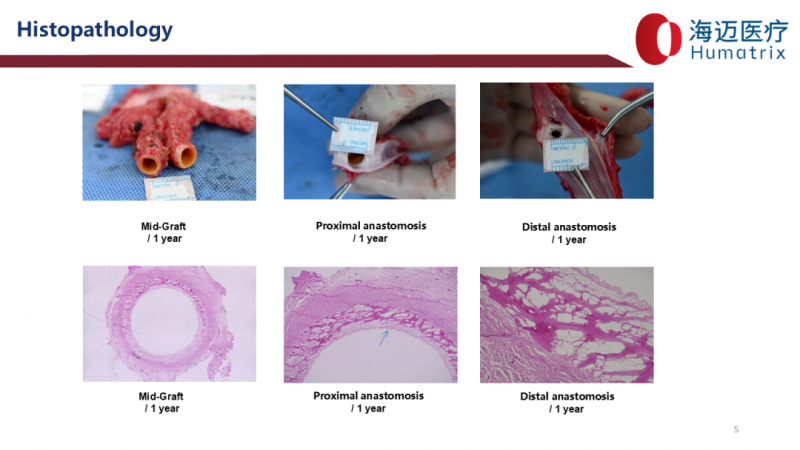
管壁采用仿生细胞外基质(ECM)结构,与天然血管高度相似,完整保留胶原纤维结构,植入体内 3-6 月可实现完全内皮化、血管外膜再细胞化,具备自我修复能力,而非单纯 “替代” 血管功能;免疫原性极低:管壁 DNA 残留量低于 10 ng/mg 组织干重(远优于国际标准的<50ng/mg),α-Gal 抗原清除率超 90%,大幅降低免疫排斥风险。
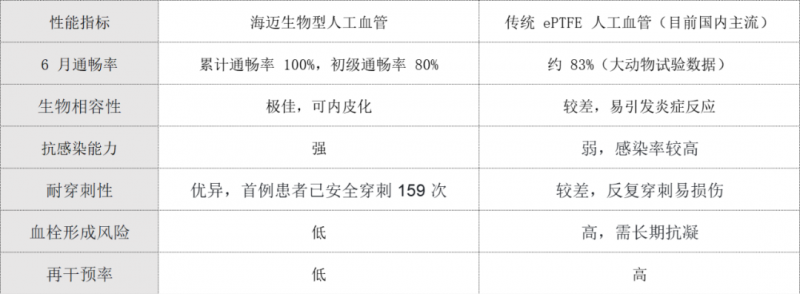
国内外产品对比
目前全球获批的小口径人工血管主要分为三类,海迈医疗产品在技术路线和临床性能上均实现差异化突破:
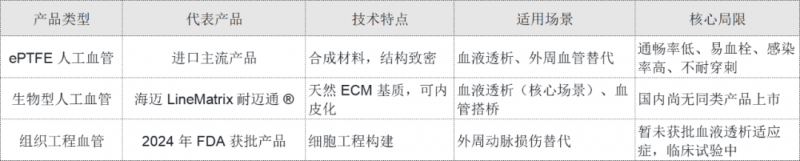
作为国产首款小口径生物型人工血管,海迈医疗产品避开了传统合成材料的短板,同时比组织工程血管更快实现血液透析场景落地,在临床需求最迫切的领域实现了“弯道超车”。